藥事通訊2019年第四期
類別:藥學(xué)信息 發(fā)布時(shí)間:2020-06-11 瀏覽人數(shù):0

2019年第4期 (總第五十九期)
諸城市人民醫(yī)院主辦 2019年12月30日
● 藥物不良反應(yīng)
加拿大警告芬太尼與中樞神經(jīng)抑制劑聯(lián)合使用的風(fēng)險(xiǎn)
加拿大衛(wèi)生部2019年5月發(fā)布信息,警告芬太尼與中樞神經(jīng)抑制劑聯(lián)合使用引起的呼吸抑制、昏迷和死亡風(fēng)險(xiǎn)。
芬太尼(枸櫞酸芬太尼,口/舌下泡騰片)僅用于治療18歲及以上的癌癥患者的突破性疼痛,這些患者已經(jīng)接受了持續(xù)的阿片類藥物治療,并且對持續(xù)的基線癌癥疼痛耐受。該藥自2014年5月起在加拿大上市。
為了確保安全、有效地使用藥物,加拿大衛(wèi)生部回顧了由制造商開展的加拿大芬太尼處方的兩項(xiàng)調(diào)查。這些調(diào)查表明一些處方醫(yī)師并未充分了解當(dāng)芬太尼與中樞神經(jīng)抑制藥物如苯二氮卓類聯(lián)合使用時(shí)的呼吸抑制、昏迷和死亡風(fēng)險(xiǎn)。加拿大衛(wèi)生部希望提醒醫(yī)務(wù)人員與芬太尼產(chǎn)品專論中的呼吸抑制、昏迷和死亡風(fēng)險(xiǎn)有關(guān)的重要安全性和使用信息。
芬太尼治療應(yīng)該只在18歲及以上對阿片類藥物耐受性強(qiáng)的患者中使用,而且僅用于治療突破性癌痛。芬太尼不能用于阿片類藥物不耐受的患者,包括根據(jù)需要間歇使用阿片類藥物的患者,因?yàn)閷τ诜情L期服用阿片類藥物的患者任何劑量都可能導(dǎo)致危及生命的呼吸抑制和死亡。阿片類藥物耐受性患者包括:每天至少口服60毫克的嗎啡;或至少使用25微克/小時(shí)的芬太尼貼劑;或每天至少口服30毫克的羥考酮;或每天至少口服8毫克的氫嗎啡酮;或每天至少口服25毫克的羥嗎啡酮(oxymorphone);或每日服用另一種等鎮(zhèn)痛劑量的阿片類藥物,持續(xù)一周或更長時(shí)間。
芬太尼與包括苯二氮卓類在內(nèi)的中樞神經(jīng)抑制劑或細(xì)胞色素P450 3A4 (CYP3A4)抑制劑合用可能導(dǎo)致呼吸抑制、低血壓、深度鎮(zhèn)靜、昏迷和死亡。
芬太尼應(yīng)謹(jǐn)慎使用,在與中樞神經(jīng)抑制劑并用時(shí)應(yīng)減少劑量,如苯二氮卓類、其他阿片類鎮(zhèn)痛藥、全麻藥、吩噻嗪類等鎮(zhèn)靜劑、鎮(zhèn)靜催眠藥、抗抑郁藥、抗精神病藥、抗組胺藥、中樞活性止吐藥等中樞神經(jīng)抑制劑(包括酒精和違禁藥物)。
同時(shí)使用芬太尼與CYP3A4抑制劑可能會(huì)增加血漿中芬太尼的濃度,從而增加抑制劑的效果。如果需要同時(shí)使用,考慮減少芬太尼的劑量,直到達(dá)到穩(wěn)定的藥物效果。應(yīng)及時(shí)監(jiān)測病人的呼吸抑制和鎮(zhèn)靜情況。CYP3A4抑制劑可能包括:茚地那韋、奈非那韋、利托那韋、克拉霉素、伊曲康唑、酮康唑、奈法佐酮、沙奎那韋、特利霉素、阿瑞匹坦、地爾硫卓、紅霉素、氟康唑、葡萄柚汁、維拉帕米或西咪替丁。同樣重要的是,患者不應(yīng)該在沒有咨詢醫(yī)生前就停止服用芬太尼,突然停藥后可能出現(xiàn)戒斷癥狀。如果不再需要該藥,接受長期治療的患者應(yīng)逐漸停藥。
加拿大衛(wèi)生部將繼續(xù)監(jiān)測有關(guān)芬太尼的安全信息,以確定和評估潛在的危害。醫(yī)務(wù)人員應(yīng)該知道,加拿大產(chǎn)品專論是根據(jù)需要定期更新的,并可從制造商或加拿大衛(wèi)生部的藥品數(shù)據(jù)庫中獲取。也鼓勵(lì)醫(yī)務(wù)人員向加拿大衛(wèi)生部報(bào)告任何懷疑與使用芬太尼有關(guān)的不良反應(yīng)。
(加拿大衛(wèi)生部網(wǎng)站)
加拿大修訂阿哌沙班的產(chǎn)品信息
加拿大衛(wèi)生部在2019年5月發(fā)布的《Health Product InfoWatch》中提醒醫(yī)務(wù)人員阿哌沙班的產(chǎn)品信息已經(jīng)修訂。
與選擇性5-羥色胺再攝取抑制劑(SSRIs)和5-羥色胺去甲腎上腺素再攝取抑制劑(SSRIs)同時(shí)使用的出血風(fēng)險(xiǎn)已包括在阿哌沙班(apixaban,商品名Eliquis)產(chǎn)品專論的警告和注意事項(xiàng)、藥物相互作用和消費(fèi)者信息部分。此外,“用法用量”部分根據(jù)適應(yīng)癥和腎功能更新了用法用量表,還增加了針對嚴(yán)重腎損害的房顫患者中風(fēng)預(yù)防的新劑量建議。
加拿大衛(wèi)生部提醒醫(yī)務(wù)人員:Eliquis與影響止血功能的藥物(如SSRIs和SNRIs)同時(shí)使用必須小心。
根據(jù)腎功能調(diào)整的劑量信息:房顫患者的中風(fēng)預(yù)防:輕度或中度腎損害患者或肌酐清除率估算值(eCrCl)為25-30 ml/min的患者無需進(jìn)行劑量調(diào)整,除非滿足以下條件中的至少2個(gè),患者則應(yīng)減少Eliquis的劑量至2.5毫克每天兩次:①年齡≥80歲;②體重≤60 kg;③患者血清肌酐高于133μmol/L(1.5 mg/dL)。表1和表2列出了腎損害患者不同適應(yīng)癥中使用Eliquis的劑量。
表1:根據(jù)適應(yīng)癥和腎功能調(diào)整的用法用量
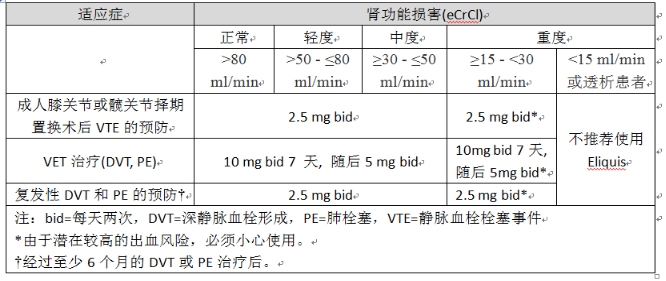
表2根據(jù)適應(yīng)癥和腎功能調(diào)整的用法用量

(加拿大衛(wèi)生部)
加拿大警告托珠單抗的肝毒性風(fēng)險(xiǎn)
2019年5月21日,加拿大衛(wèi)生部發(fā)布信息,患者使用托珠單抗(tocilizumab,商品名:雅美羅)治療過程中報(bào)道了嚴(yán)重的藥物性肝損傷,在某些情況下導(dǎo)致需要移植的急性肝衰竭。
目前建議醫(yī)務(wù)人員:不推薦雅美羅治療存在肝病或肝功能損害的患者;對于肝酶水平升高超過正常上限3倍的患者,不要使用雅美羅治療;對肝酶水平超過正常上限 5倍的患者停止雅美羅治療;肝酶水平高于正常上限 1.5倍的患者考慮雅美羅治療時(shí)要謹(jǐn)慎;類風(fēng)濕性關(guān)節(jié)炎和巨細(xì)胞動(dòng)脈炎患者在治療前6個(gè)月內(nèi)每4至8周需要檢查肝功能,之后每12周檢查一次;第二次雅美羅治療開始前,以及用藥每2至4周之后需要檢查多關(guān)節(jié)型幼年特發(fā)性關(guān)節(jié)炎和全身型幼年特發(fā)性關(guān)節(jié)炎患者的肝功能;請參閱獲批的加拿大產(chǎn)品專論查找有關(guān)肝酶升高患者用藥推薦劑量的調(diào)整指導(dǎo)信息(減少、中斷或停藥); 如果患者出現(xiàn)肝臟損傷跡象,如食欲不振、惡心和嘔吐、疲勞、瘙癢、尿色深、皮膚和眼睛發(fā)黃、腹部腫脹和/或右上腹部疼痛,建議患者聯(lián)系醫(yī)務(wù)人員。
加拿大衛(wèi)生部正在與藥品生產(chǎn)企業(yè)合作,將這一新的安全性信息納入加拿大產(chǎn)品專論。
(加拿大衛(wèi)生部網(wǎng)站)
英國建議托法替布禁用于有肺栓塞高風(fēng)險(xiǎn)的患者
2019年5月17日,英國藥品和健康產(chǎn)品管理局(MHRA)發(fā)布信息稱,基于一項(xiàng)對托法替布(Tofacitinib)臨床研究的觀察結(jié)果,針對該藥的安全性評估已啟動(dòng),建議增加新的禁忌癥,即托法替布禁用于有肺栓塞高風(fēng)險(xiǎn)的患者。
基于正在開展的托法替布在50歲及以上且至少有一種心血管風(fēng)險(xiǎn)因素的類風(fēng)濕患者中的研究(A3921133研究),歐洲啟動(dòng)了對該藥的評估工作。研究發(fā)現(xiàn),與一種腫瘤壞死因子(TNF)抑制劑相比,當(dāng)患者給予托法替布每日2次、每次10mg的用法(為類風(fēng)濕關(guān)節(jié)炎患者建議劑量的2倍)時(shí),患者肺栓塞風(fēng)險(xiǎn)和總死亡率增加。
鑒于每日2次、每次10mg的用法已被建議用于潰瘍性結(jié)腸炎的初始治療(療程最長達(dá)16周),直至該項(xiàng)評估結(jié)束,有肺栓塞高風(fēng)險(xiǎn)的潰瘍性結(jié)腸炎患者不應(yīng)使用托法替布進(jìn)行初始治療。已經(jīng)以每日2次、每次10mg用法治療且有肺栓塞高風(fēng)險(xiǎn)的患者應(yīng)替換為其他藥物進(jìn)行治療。
上述風(fēng)險(xiǎn)正在深入評估中,這期間,托法替布每日2次、每次10mg用法禁用于有下述一項(xiàng)或多項(xiàng)肺栓塞風(fēng)險(xiǎn)因素的患者:使用復(fù)合激素避孕或激素替代治療患者;心衰患者;既往靜脈血栓栓塞患者,如深靜脈血栓或肺栓塞;遺傳性凝血障礙患者;惡性腫瘤患者;接受大手術(shù)的患者。
此外,在以每日2次、每次10mg處方托法替布時(shí),關(guān)于肺栓塞的其他風(fēng)險(xiǎn)因素應(yīng)被考慮,包括年齡、肥胖(BMI>30kg/m2)、吸煙和骨固定手術(shù)史。接受托法替布治療的患者,無論是何適應(yīng)癥,應(yīng)監(jiān)測肺栓塞的癥狀和體征,如患者出現(xiàn)相關(guān)癥狀和體征,應(yīng)立刻就醫(yī)。
(英國MHRA網(wǎng)站)
新西蘭警告列汀類降糖藥的大皰性類天皰瘡風(fēng)險(xiǎn)
2019年5月7日,新西蘭藥品和醫(yī)療器械安全管理局(Medsafe)發(fā)布信息,警告列汀類抗糖尿病藥引起的大皰性類天皰瘡風(fēng)險(xiǎn)。
最近,有文獻(xiàn)顯示用于治療2型糖尿病的二肽基肽酶-4(DPP-4)抑制劑(也稱為“列汀類”)與大皰性類天皰瘡相關(guān)。
大皰性類天皰瘡是一種自身免疫性疾病,會(huì)導(dǎo)致表皮下水皰。自身抗體和活化的T淋巴細(xì)胞以表皮基底膜中的蛋白質(zhì)為靶標(biāo),觸發(fā)炎性進(jìn)程,導(dǎo)致水皰形成。大多數(shù)大皰性類天皰瘡的病例發(fā)生于60歲以上個(gè)體,其通常表現(xiàn)為重度瘙癢和充滿液體的大水皰(1-3厘米),稱為大皰。大皰最終破裂,留下濕潤的糜爛皮損,結(jié)痂后痊愈而無瘢痕形成,也可能累級黏膜。大皰性類天皰瘡?fù)ǔJ且环N自限性疾病,其臨床病程可持續(xù)數(shù)月至數(shù)年。然而,它也可能是一種嚴(yán)重且潛在致死性疾病,尤其是當(dāng)皮損分布廣泛或?qū)χ委熌退帟r(shí)。
大皰性類天皰瘡的風(fēng)險(xiǎn)升高與下列因素有關(guān):高齡;HLA關(guān)聯(lián)提示遺傳易感性;暴露于某些藥物;合并神經(jīng)系統(tǒng)疾病(例如卒中、癡呆、帕金森病)、銀屑病、癌癥、皮膚感染等。
藥物性大皰性類天皰瘡的病例報(bào)告中最常見涉及青霉胺和呋塞米。在國際上也已報(bào)告了與卡托普利、青霉素及其衍生物、柳氮磺胺吡啶和局部用氟尿嘧啶相關(guān)的病例。病例對照研究發(fā)現(xiàn)大皰性類天皰瘡與神經(jīng)安定藥、髓袢利尿藥和螺內(nèi)酯存在顯著相關(guān)性。
最近,有文獻(xiàn)顯示DPP-4抑制劑與大皰性類天皰瘡相關(guān)。該關(guān)聯(lián)性的證據(jù)最初基于病例報(bào)告和國家藥物警戒數(shù)據(jù)庫分析,且現(xiàn)已包含了對照性觀察性研究。尚未充分了解DPP-4抑制劑與大皰性類天皰瘡間關(guān)聯(lián)性的病理機(jī)制。
在新西蘭獲批的DPP-4抑制劑有維格列汀、西格列汀和沙格列汀。在維格列汀和西格列汀的數(shù)據(jù)表中,大皰性類天皰瘡被列為源自上市后經(jīng)驗(yàn)的不良事件。1965年至2018年間,新西蘭不良反應(yīng)監(jiān)測中心收到20例懷疑是由藥物引起類天皰瘡的不良反應(yīng)報(bào)告。其中1例報(bào)告與D-青霉胺有關(guān),3例與青霉素衍生物有關(guān),1例與呋塞米有關(guān)。尚無涉及與DPP-4抑制劑相關(guān)的類天皰瘡反應(yīng)方面的報(bào)告。
若懷疑某種藥物可引起大皰性類天皰瘡,請停藥并考慮轉(zhuǎn)診至皮膚科專科醫(yī)師。大皰性類天皰瘡的一線治療通常涉及局部或全身用皮質(zhì)類固醇和支持性治療,但也可能需要免疫抑制劑治療。
(新西蘭Medsafe網(wǎng)站)
日本警告奧司他韋的出血風(fēng)險(xiǎn)
2019年3月,日本厚生勞動(dòng)省(MHLW)和藥械管理局(PMDA)宣布,奧司他韋(商品名為達(dá)菲)的說明書應(yīng)進(jìn)行修訂,以包含不良反應(yīng)出血以及與華法林合并使用的注意事項(xiàng)。奧司他韋批準(zhǔn)用于A型和B型流感病毒的預(yù)防和治療。在既往3個(gè)財(cái)政年度期間,日本共報(bào)告了30例使用奧司他韋治療的患者發(fā)生出血的病例,其中的3例病例與產(chǎn)品的因果關(guān)系不能排除。至今未報(bào)告患者死亡的病例。此外,在奧司他韋和華法林聯(lián)用的患者中未報(bào)告有出血的病例。MHLW和PMDA得出結(jié)論認(rèn)為,基于目前對可獲得證據(jù)審查的結(jié)果,有必要對產(chǎn)品說明書進(jìn)行修訂。
(WHO Newsletter)
日本警告納武利尤單抗的嚴(yán)重血液系統(tǒng)異常風(fēng)險(xiǎn)
日本厚生勞動(dòng)省(MHLW)及藥品和醫(yī)療器械管理局(PMDA)近期宣布,納武利尤單抗(nivolumab,商品名:歐狄沃)的產(chǎn)品說明書應(yīng)做修改,在不良反應(yīng)項(xiàng)下增加噬血細(xì)胞綜合征、溶血性貧血以及粒細(xì)胞缺乏癥。
納武利尤單抗在日本用于治療多種癌癥,如惡性黑色素瘤、不可切除的晚期或復(fù)發(fā)性非小細(xì)胞肺癌、復(fù)發(fā)或難治的經(jīng)典霍奇金淋巴瘤。在此前的三個(gè)財(cái)政年度中,日本共報(bào)告10例發(fā)生噬血細(xì)胞綜合征的病例,其中3例無法排除與用藥的因果關(guān)聯(lián)性;共報(bào)告15例發(fā)生溶血性貧血、且無法排除與用藥的因果關(guān)聯(lián)性的病例;有1例死亡報(bào)告。共報(bào)告33例發(fā)生中性粒細(xì)胞減少癥(包括粒細(xì)胞缺乏癥)的病例,其中12例無法排除和用藥的因果關(guān)聯(lián)性。
基于對當(dāng)前已有證據(jù)的評估結(jié)果, MHLW及PMDA認(rèn)為有必要修改納武利尤單抗的產(chǎn)品說明書。
(WHO Pharmaceuticals Newsletter)
日本警告帕博利珠單抗的噬血細(xì)胞綜合征和粒細(xì)胞缺乏風(fēng)險(xiǎn)
日本厚生勞動(dòng)省(MHLW)及藥品和醫(yī)療器械管理局(PMDA)近期宣布,帕博利珠單抗(Pembrolizumab,商品名:可瑞達(dá))的產(chǎn)品說明書應(yīng)做修改,在不良反應(yīng)項(xiàng)下增加噬血細(xì)胞綜合征以及粒細(xì)胞缺乏癥。
帕博利珠單抗在日本用于治療惡性黑色素瘤、不可切除的晚期或復(fù)發(fā)性非小細(xì)胞肺癌、以及復(fù)發(fā)或難治的經(jīng)典霍奇金淋巴瘤。在此前的三個(gè)財(cái)政年度中,日本共報(bào)告9例發(fā)生噬血細(xì)胞綜合征、7例發(fā)生粒細(xì)胞缺乏癥的接受帕博利珠單抗治療的病例。在9例發(fā)生噬血細(xì)胞綜合征的病例中,其中7例無法排除與用藥的因果關(guān)聯(lián)性,有1例死亡報(bào)告,該例患者與用藥的因果關(guān)聯(lián)性不成立。在7例發(fā)生粒細(xì)胞缺乏癥的病例中,有4例無法排除與用藥的因果關(guān)聯(lián)性。
基于對當(dāng)前已有證據(jù)的評估結(jié)果, MHLW及PMDA認(rèn)為有必要修改帕博利珠單抗的產(chǎn)品說明書。
歐盟警示呼吸系統(tǒng)藥物細(xì)菌溶解產(chǎn)物僅用于預(yù)防復(fù)發(fā)性感染
2019年6月28日,歐盟藥品管理局(EMA)發(fā)布信息,建議批準(zhǔn)用于呼吸系統(tǒng)的細(xì)菌溶解產(chǎn)物應(yīng)僅用于預(yù)防復(fù)發(fā)性呼吸道感染,肺炎除外。這是根據(jù)一項(xiàng)評估得出的結(jié)論:沒有可靠數(shù)據(jù)顯示這些藥物在治療現(xiàn)有呼吸道感染或預(yù)防肺炎是有效的,因此這樣藥物不應(yīng)用于這些治療目的。在此項(xiàng)評估中,EMA人用藥品委員會(huì)(CHMP)考慮了臨床試驗(yàn)的結(jié)果、這些藥物報(bào)告的副作用的數(shù)據(jù)以及傳染病專家組的建議。
盡管數(shù)據(jù)有限,評估發(fā)現(xiàn)了這些藥物的預(yù)防復(fù)發(fā)性呼吸道感染的一些有效性證據(jù),安全性特征也與此類產(chǎn)品預(yù)期的一致。CHMP因此建議可以繼續(xù)使用這些藥物用于預(yù)防,但是公司必須在2026年從新的臨床研究中提供更多的安全性和療效數(shù)據(jù)。
給患者的信息
* 細(xì)菌溶解產(chǎn)物不應(yīng)用于治療現(xiàn)有的氣道感染或用于預(yù)防肺炎(一種肺部感染),因?yàn)闆]有充分的數(shù)據(jù)表明這些用途是有效的。
* 細(xì)菌溶解產(chǎn)物可以繼續(xù)用于那些經(jīng)常因?yàn)楦腥痉磸?fù)就診的患者的氣道感染(肺炎除外)預(yù)防。
* 如果您有感染性疾病且正使用細(xì)菌溶解產(chǎn)物治療,或者您正使用任何一種此類藥物預(yù)防肺炎,請聯(lián)系經(jīng)治醫(yī)生或藥師以獲得關(guān)于替代方案的建議。
* 如果您有任何關(guān)于您使用藥物的問題或擔(dān)憂,請與您的醫(yī)生和藥師進(jìn)行討論。
給醫(yī)務(wù)人員的信息
* 細(xì)菌溶解產(chǎn)物的適應(yīng)癥已限制在僅用于預(yù)防復(fù)發(fā)性呼吸道感染,肺炎除外。細(xì)菌溶解產(chǎn)物由于缺乏有效性不應(yīng)處方用于治療現(xiàn)有的呼吸道感染或預(yù)防肺炎。
* 這些藥物的處方信息將被更新,修訂用于預(yù)防肺炎的適應(yīng)癥和警告相關(guān)信息。
細(xì)菌溶解產(chǎn)物由分解的細(xì)菌細(xì)胞制成,旨在刺激免疫系統(tǒng)以識(shí)別和對抗感染。這些藥物可以口服給藥(作為膠囊、片劑、顆粒/粉末,用于制備口服混合物或滴劑),可以舌下溶解(作為片劑),可以鼻腔吸入(作為液體制劑),或通過肌注或皮下注射給藥。細(xì)菌溶解產(chǎn)物是通過國家程序批準(zhǔn)上市的。
此項(xiàng)評估是CHMP開展的,已采納了監(jiān)管機(jī)構(gòu)的意見,CHMP主要負(fù)責(zé)人用藥品相關(guān)的問題。CHMP的意見將報(bào)送歐盟委員會(huì)(European Commission),歐盟委員會(huì)將簽署最終的具有法律約束力的決定,以適用于所有的歐盟成員國。
原文鏈接如下:
https://www.ema.europa.eu/en/news/bacterial-lysate-medicines-respiratory-conditions-be-used-only-prevention-recurrent-infections
(歐盟EMA網(wǎng)站)
EMA建議采取新措施以避免甲氨蝶呤給藥劑量錯(cuò)誤
2019年7月12日,歐洲藥品管理局(EMA)網(wǎng)站發(fā)布信息,建議采取新措施以避免甲氨蝶呤給藥劑量錯(cuò)誤。
EMA的藥物警戒和風(fēng)險(xiǎn)評估委員會(huì)(PRAC)建議采取新的措施以避免發(fā)生含甲氨蝶呤藥品的給藥劑量錯(cuò)誤,已有部分患者對應(yīng)該每周給藥的此類藥品錯(cuò)誤的采取了每日給藥方式。
新的措施包括限制可以處方該類藥品的人員范圍,在產(chǎn)品包裝上突出警告信息,為患者和醫(yī)務(wù)人員提供教育材料。此外,為幫助患者遵從每周一次的給藥方案,每周給藥的甲氨蝶呤片將改為泡罩包裝,而不使用瓶或管裝。
甲氨蝶呤用于治療炎性疾病和癌癥。當(dāng)用于炎性疾病,例如關(guān)節(jié)炎和銀屑病時(shí),為每周給藥一次;用于某些類型的癌癥時(shí),給藥劑量更大、給藥次數(shù)更頻繁。甲氨蝶呤處方或分發(fā)錯(cuò)誤以及對給藥方案的理解錯(cuò)誤,使得患者在治療炎性疾病時(shí),每天使用該藥而不是每周使用一次,造成了包括死亡在內(nèi)的嚴(yán)重后果。
含甲氨蝶呤藥品的給藥劑量錯(cuò)誤風(fēng)險(xiǎn)已廣為人知。但是,盡管已經(jīng)采取了一些措施,此類問題仍有報(bào)告。
PRAC審查了現(xiàn)有證據(jù),建議采取額外措施減少給藥劑量錯(cuò)誤,以保障含甲氨蝶呤藥品的獲益繼續(xù)大于風(fēng)險(xiǎn)。有關(guān)措施已與患者和醫(yī)務(wù)人員協(xié)商達(dá)成一致。
防止發(fā)生含甲氨蝶呤藥品給藥劑量錯(cuò)誤的措施
* 只有具備使用含甲氨蝶呤藥品經(jīng)驗(yàn)的醫(yī)生才能處方該藥。
* 醫(yī)務(wù)人員應(yīng)確保患者或其護(hù)理人員能遵從每周一次的給藥方案。
* 為避免混淆,應(yīng)刪除片劑的產(chǎn)品說明中有關(guān)拆分劑量使用的建議。
* 所有每周使用一次的含甲氨蝶呤藥品的包裝上,應(yīng)以醒目的方式提示該藥應(yīng)如何使用。
* 為使用甲氨蝶呤口服制劑治療炎性疾病的患者提供患者須知卡,強(qiáng)調(diào)每周服用一次。
* 為醫(yī)務(wù)人員提供甲氨蝶呤口服制劑的教育材料,并據(jù)此向患者提供咨詢。
* 為幫助患者遵從每周一次的給藥劑量,甲氨蝶呤片劑改為泡罩包裝,而不使用瓶或管裝。
PRAC的建議將提交給人用醫(yī)療產(chǎn)品委員會(huì)(CHMP),由后者決定是否采納。
將以書面形式通知醫(yī)務(wù)人員上述信息。在此期間患者如有任何疑問應(yīng)咨詢醫(yī)生或藥師。
關(guān)于藥品的進(jìn)一步信息
含甲氨蝶呤的藥品用于治療急性淋巴細(xì)胞性白血病等癌癥以及各種炎性疾病,包括類風(fēng)濕性關(guān)節(jié)炎、幼年特發(fā)性關(guān)節(jié)炎、銀屑病、銀屑病關(guān)節(jié)炎和克羅恩病。
甲氨蝶呤的給藥途徑包括口服和注射。
大多數(shù)含甲氨蝶呤藥品通過國家審批程序上市,所有歐盟國家均有此類藥品銷售,商品名有多個(gè),包括:Ledertrexate、Maxtrex、Metex、Metoject。Jylamvo(口服)和Nordimet(注射劑)是唯一通過集中審批程序上市的含甲氨蝶呤藥品。
關(guān)于評估程序的進(jìn)一步信息
此項(xiàng)評估應(yīng)西班牙的要求啟動(dòng)。
此項(xiàng)評估由PRAC開展,該委員會(huì)負(fù)責(zé)評估人用藥品的安全問題并提出建議。PRAC的建議將提交給人用醫(yī)療產(chǎn)品委員會(huì)(CHMP),該委員會(huì)負(fù)責(zé)處理有關(guān)人用藥品的問題并決定是否采納PRAC的意見。評估程序的最后一步是提交歐洲委員會(huì)(EC)討論,一經(jīng)EC采納將形成適用于所有歐盟成員國的具有法律約束力的決定。
原文鏈接如下:
https://www.ema.europa.eu/en/news/prac-recommends-new-measures-avoid-dosing-errors-methotrexate
(歐盟EMA網(wǎng)站)
歐盟警示服用柳氮磺吡啶干擾煙酰胺腺嘌呤二核苷酸/煙酰胺腺嘌呤二核苷酸磷酸反應(yīng)測定結(jié)果
2019年7月,歐洲藥品管理局藥物警戒委員會(huì)(PRAC)發(fā)布產(chǎn)品風(fēng)險(xiǎn)信號(hào),提示服用柳氮磺吡啶會(huì)干擾煙酰胺腺嘌呤二核苷酸(NADH)/煙酰胺腺嘌呤二核苷酸磷酸(NADP)反應(yīng)測定結(jié)果,該結(jié)論是基于對現(xiàn)有所獲得的數(shù)據(jù)(文獻(xiàn)、EudraVigilance數(shù)據(jù)庫)進(jìn)行評估后所發(fā)現(xiàn)的。
PRAC認(rèn)為所有近期可獲得的數(shù)據(jù)都表明,柳氮磺吡啶會(huì)干擾以NADH/NADP為基礎(chǔ)的實(shí)驗(yàn)室檢測結(jié)果,并要求產(chǎn)品許可持有人在2個(gè)月內(nèi)提交說明書變更模板,說明書修訂信息按照以下要求進(jìn)行(帶下劃線的部分為新增內(nèi)容):
一、產(chǎn)品特征概要(SmPC)修訂內(nèi)容
4.4特殊警告和使用注意事項(xiàng)
在服用柳氮磺吡啶前以及開始治療后的前三個(gè)月,每兩周需要進(jìn)行完整的血細(xì)胞計(jì)數(shù),包括差異白細(xì)胞計(jì)數(shù)以及肝功能的檢測。在開始治療的第二個(gè)三個(gè)月間期,應(yīng)每月開展一次同樣的測試,之后每三個(gè)月進(jìn)開展一次,并根據(jù)臨床提示進(jìn)行。所有患者的腎功能評估(包括尿檢)應(yīng)在治療開始時(shí)開展,并在治療的前三個(gè)月至少每月進(jìn)行一次;此后,應(yīng)按臨床提示進(jìn)行監(jiān)測。在柳氮磺吡啶治療期間一些臨床癥狀的出現(xiàn),如喉嚨痛,發(fā)燒,蒼白,紫癜,或黃疸,提示患者可能出現(xiàn)了骨髓抑制,溶血,或肝毒性。此時(shí)應(yīng)停止使用柳氮磺吡啶治療,等待血液檢測結(jié)果。請參考4.4章節(jié)“干擾實(shí)驗(yàn)室檢測結(jié)果”。
干擾實(shí)驗(yàn)室檢測結(jié)果
目前已觀察到暴露于柳氮磺吡啶或其代謝物美沙拉嗪的患者中,尿液異丙腎上腺素的液相色譜測量受到干擾,出現(xiàn)假陽性的檢測結(jié)果。柳氮磺吡啶及其代謝產(chǎn)物會(huì)干擾紫外線的吸收,尤其在340nm處;也會(huì)干擾在340nm波長附近采用NADH/NADP測量紫外吸收的實(shí)驗(yàn)室測定結(jié)果,常見的例子有尿素氮、氨氣、乳酸鹽脫氫酶(LDH)、羥丁酸脫氫酶(α-HBDH)、葡萄糖的測定。在采用柳氮磺吡啶高劑量治療的患者中,甚至丙氨酸轉(zhuǎn)氨酶(ALT)、天門冬氨酸轉(zhuǎn)氨酶(AST)、肌酸激酶(CK-MB)、谷氨酸脫氫酶(GLDH)或者甲狀腺素的測量都可能受到干擾,因此應(yīng)對上述檢測使用的檢測方法與測試實(shí)驗(yàn)室進(jìn)行協(xié)商。對于采用柳氮磺吡啶治療的患者,在解釋上述實(shí)驗(yàn)室測定結(jié)果時(shí)應(yīng)謹(jǐn)慎,同時(shí)需結(jié)合臨床發(fā)現(xiàn)解釋上述檢測結(jié)果。
二、包裝說明書(Package leaflet)修訂內(nèi)容
2.在開始柳氮磺吡啶治療前你需要知道
如果你正在服用或最近服用柳氮磺吡啶,或任何其他含有柳氮磺吡啶的產(chǎn)品,請告知你的醫(yī)生,因?yàn)樗鼈兛赡苡绊懷汉湍蛞簷z測結(jié)果。
原文鏈接如下:
https://www.ema.europa.eu/en/human-regulatory/post-authorisation/pharmacovigilance/signal-management/prac-recommendations-safety-signals#prac-recommendations-on-safety-signals:-monthly-overviews-section
(EMA網(wǎng)站)
歐盟修訂洛哌丁胺、蘇金單抗、替莫唑胺和托吡酯的產(chǎn)品說明書
2019年6月14日,歐盟藥品管理局(EMA)網(wǎng)站發(fā)布信息,采納了藥品風(fēng)險(xiǎn)評估委員會(huì)(PRAC)對洛哌丁胺、蘇金單抗、替莫唑胺、托吡酯的信號(hào)評價(jià)意見,并建議對這些品種的產(chǎn)品信息進(jìn)行修訂。相關(guān)藥品的上市許可持有人應(yīng)在2個(gè)月內(nèi)提交針對修訂內(nèi)容的變更申請。具體修訂內(nèi)容如下:
一、洛哌丁胺與Brugada 綜合征
基于針對洛哌丁胺的Brugada 綜合征風(fēng)險(xiǎn)的數(shù)據(jù)評估,PRAC同意含洛哌丁胺藥品進(jìn)行以下產(chǎn)品信息的修訂(新增內(nèi)容見劃線部分):
產(chǎn)品特征概要(SPC):
4.4. 特殊的警告與注意事項(xiàng):
QT間期和QRS復(fù)合波延長以及尖端扭轉(zhuǎn)性室性心動(dòng)過速已報(bào)告與用藥過量相關(guān),一些病例出現(xiàn)了死亡結(jié)局(見4.9部分)。藥物過量可以激發(fā)現(xiàn)有的 Brugada 綜合征。患者不應(yīng)超過治療的推薦劑量和/或推薦療程。
4.9. 藥物過量
在那些攝入過量鹽酸洛哌丁胺的患者中可觀察到心臟不良事件,包括QT 間期和 QRS 復(fù)合波延長、 尖端扭轉(zhuǎn)性室性心動(dòng)過速以及其他嚴(yán)重的心律失常、心臟停搏以及暈厥(見4.4部分)。也報(bào)告一些死亡病例。藥物過量可以激發(fā)現(xiàn)有的Brugada綜合征。
二、司庫奇尤單抗與全身剝脫性皮炎
PRAC通過評估目前來自歐盟藥物警戒數(shù)據(jù)庫(EudraVigilance)、文獻(xiàn)報(bào)道以及諾華公司提交累積數(shù)據(jù)分析的證據(jù),同意司庫奇尤單抗注射液進(jìn)行以下產(chǎn)品信息的修訂(新增內(nèi)容見劃線部分)
產(chǎn)品特征概要:
4.8 不良反應(yīng)
皮膚及其附件損害:罕見:剝脫性皮炎,銀屑病患者中已報(bào)告相關(guān)病例。
包裝說明書(Package leaflet)
4. 可能的副作用
罕見(可能1/1000的發(fā)生率)
* 嚴(yán)重過敏性休克(過敏反應(yīng))
* 全身大面積皮膚發(fā)紅和脫落,這可能伴有瘙癢或疼痛(剝脫性皮炎)
三、替莫唑胺與伴嗜酸性細(xì)胞增多癥和全身癥狀的藥物反應(yīng)(DRESS)
PRAC通過評估目前來自歐盟藥物警戒數(shù)據(jù)庫(EudraVigilance)、文獻(xiàn)報(bào)道以及已知替莫唑胺與嚴(yán)重皮膚反應(yīng)相關(guān)的證據(jù),同意對含替莫唑胺藥品進(jìn)行以下產(chǎn)品信息的修訂(新增內(nèi)容見劃線部分):
產(chǎn)品特征概要:
4.8 不良反應(yīng)
不良反應(yīng)列表中皮膚及其附件損害:發(fā)生率“罕見”:伴嗜酸性細(xì)胞增多癥和全身癥狀的藥物反應(yīng)(DRESS)。
四、托吡酯與葡萄膜炎
通過評估目前獲得的證據(jù),包括上市許可持有人累及數(shù)據(jù)分析,一些無混雜疾病因素的患者開始托吡酯治療后很快發(fā)生雙側(cè)葡萄膜炎,且停止托吡酯治療后葡萄膜炎快速緩解,PRAC得出結(jié)論認(rèn)為托吡酯和葡萄膜炎事件有因果關(guān)聯(lián)性。因此,PRAC同意含托吡酯藥品進(jìn)行以下產(chǎn)品信息的修訂(新增內(nèi)容見劃線部分):
產(chǎn)品特性概要
4.8 不良反應(yīng)
眼部疾病:發(fā)生率未知:葡萄膜炎。
包裝說明書
4. 可能的副作用
如果您發(fā)生了以下不良反應(yīng)請告知醫(yī)生或立即就醫(yī):
發(fā)生率未知(從目前可獲得的數(shù)據(jù)中不能估計(jì)發(fā)生率)
—眼部感染(葡萄膜炎)并有以下癥狀:如眼部的發(fā)紅、疼痛、怕光、流淚、看到小圓點(diǎn)或視物模糊。
原文鏈接如下:
https://www.ema.europa.eu/en/documents/prac-recommendation/prac-recommendations-signals-adopted-13-16-may-2019-prac-meeting_en-0.pdf
(EMA網(wǎng)站)
加拿大衛(wèi)生部發(fā)布對含丙泊酚的產(chǎn)品安全性評估概要
2019-07-12加拿大衛(wèi)生部評估含丙泊酚的產(chǎn)品陰莖持續(xù)勃起的潛在風(fēng)險(xiǎn)(陰莖異常勃起)
關(guān)鍵信息
含丙泊酚的產(chǎn)品是兒童和成人的手術(shù)或其他醫(yī)療中使用的鎮(zhèn)靜/麻醉藥物。
加拿大衛(wèi)生部對加拿大報(bào)告的病例進(jìn)行評價(jià),評估了由含有丙泊酚的產(chǎn)品的性刺激(陰莖異常勃起)引起的長期和疼痛勃起的風(fēng)險(xiǎn)。
加拿大衛(wèi)生部的評估得出結(jié)論,含丙泊酚的產(chǎn)品與陰莖異常勃起的風(fēng)險(xiǎn)之間可能存在聯(lián)系。
加拿大衛(wèi)生部將通知含丙泊酚產(chǎn)品的制造商更新加拿大產(chǎn)品安全信息,以告知加拿大人和醫(yī)療保健專業(yè)人員這一潛在的安全問題。
概述
加拿大衛(wèi)生部啟動(dòng)了一項(xiàng)安全性評價(jià),以評估有關(guān)使用含丙泊酚產(chǎn)品的陰莖異常勃起的潛在風(fēng)險(xiǎn)。含丙泊酚產(chǎn)品用于在手術(shù)或其他醫(yī)療措施期間使患者放松,平靜或困倦(鎮(zhèn)靜)或無意識(shí)(麻醉)。
陰莖持續(xù)勃起是非性刺激引起的痛性的陰莖勃起,陰莖異常勃起罕見但可能后果嚴(yán)重,如果不及時(shí)治療這種情況,可能會(huì)導(dǎo)致永久性殘疾,例如無法勃起并保持有效的勃起(勃起功能障礙)。
加拿大衛(wèi)生部的評價(jià)是由加拿大一名患者進(jìn)行陰莖異常勃起的報(bào)告引發(fā)的,該患者在醫(yī)療過程中使用用含丙泊酚的產(chǎn)品進(jìn)行鎮(zhèn)靜。
丙泊酚在加拿大使用情況
含丙泊酚的產(chǎn)品是經(jīng)授權(quán)在加拿大銷售并由醫(yī)療保健專業(yè)人員用于在手術(shù)或醫(yī)療程序期間使患者(成人或兒童)放松,平靜或困倦(鎮(zhèn)靜)或無意識(shí)(麻醉)的處方藥。
含丙泊酚的產(chǎn)品自1993年以商標(biāo)名Diprivan在加拿大上市。加拿大丙泊酚也屬于通用名藥,丙泊酚為10 mg / mL注射液。
安全評價(jià)結(jié)果
在對含丙泊酚產(chǎn)品進(jìn)行評價(jià)時(shí),加拿大衛(wèi)生部已收到一例有關(guān)使用含有丙泊酚的產(chǎn)品陰莖異常勃起。對該報(bào)告的回顧發(fā)現(xiàn)含丙泊酚的產(chǎn)品與陰莖異常勃起之間可能存在聯(lián)系。
該安全性評價(jià)還評價(jià)了10份國際公開的報(bào)告。含丙泊酚的產(chǎn)品與陰莖異常勃起之間關(guān)聯(lián)性2例為很可能,7例為可能,1例陰莖異常勃起與含丙泊酚產(chǎn)品使用可能無關(guān)。
在大多數(shù)報(bào)告(9/11)中,陰莖異常勃起發(fā)生在丙泊酚給藥后5分鐘至2小時(shí)之間。
大多數(shù)患者(10/11)在陰莖異常勃起治療后恢復(fù),只有1例報(bào)告長期異常(持續(xù)的勃起功能障礙)。
結(jié)論和措施
加拿大衛(wèi)生部的評價(jià)發(fā)現(xiàn),含丙泊酚的產(chǎn)品與陰莖異常勃起的風(fēng)險(xiǎn)之間可能存在關(guān)聯(lián)。
加拿大衛(wèi)生部已經(jīng)批準(zhǔn)Diprivan 1%的加拿大產(chǎn)品信息增加陰莖異常勃起的風(fēng)險(xiǎn)。加拿大衛(wèi)生部將告知其他含丙泊酚的產(chǎn)品制造商,要求其更新加拿大含丙泊酚產(chǎn)品安全信息,告知加拿大人和醫(yī)療保健專業(yè)人員這一潛在的安全問題。
加拿大衛(wèi)生部將繼續(xù)監(jiān)測涉及含丙泊酚產(chǎn)品的安全風(fēng)險(xiǎn)以識(shí)別和評估潛在的危害并及時(shí)更新其風(fēng)險(xiǎn)信息,如果發(fā)現(xiàn)任何新的健康風(fēng)險(xiǎn),加拿大衛(wèi)生部將采取適當(dāng)和及時(shí)的行動(dòng)。
附加信息
該安全性評價(jià)是基于包括科學(xué)和醫(yī)學(xué)文獻(xiàn)、加拿大和國際不良反應(yīng)報(bào)告以及在加拿大和國際上使用這些藥物的已知情況。